-
Le danger d'HF
Pourquoi des fluorures en milieu acide sont ils aussi dangereux que l'acide fluorhydrique ?
Les fluorures en milieu acide, comme l'acide fluorhydrique HF, génèrent une double action :
- corrosive par les ions H+ de l'acide ;
- toxique par les ions fluorures F- qui, du fait de la destruction de la couche superficielle de la peau ou de l'œil par l'acide, vont pouvoir pénétrer en profondeur, chélater le calcium et le magnésium, perturbant ainsi les équilibres biologiques. Les résultats sont des nécroses très importantes et des perturbations de différents cycles métaboliques.
L'action de l'acide est principalement destructrice sur les couches superficielles, alors que l'ion fluorure agit très peu sur ces mêmes couches. La destruction de ces couches superficielles permet ensuite à l'HF et aux ions fluorures qu'il libère progressivement, de s'infiltrer et de progresser vers les tissus plus profonds, provoquant leur nécrose de liquéfaction. C'est ce mécanisme spécifique qui différencie l'HF des autres acides et, en particulier, des acides forts qui provoquent une nécrose de coagulation avec précipitation des protéines tissulairesb.
Schématiquement :
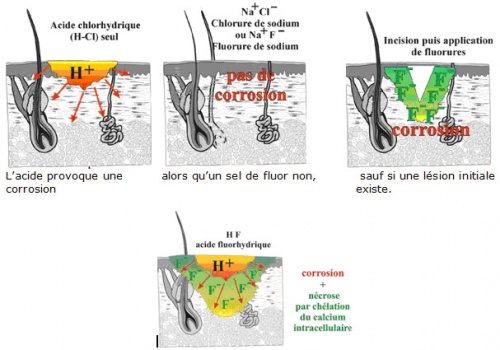
Retenir : C'est la double présence de H+ et F- dans le même milieu qui est responsable du risque HF.
H+ peut être apporté dans le milieu par n'importe quel acide – F- par les fluorures.Dans l'équilibre HF <-> H+ + F-, H+ est donc la première entité consommée.
Plus le milieu sera acide, plus la concentration en acide (autrement dit la concentration en H+) sera importante dans le mélange, et plus les ions fluorures seront libres et pourront réagir (loi de Le Chatelier).
C'est pourquoi les mélanges chimiques à base d'acide fluorhydrique ont une classification spécifique, avec des règles plus sévères pour un produit très toxique, car le risque HF persiste même dans les faibles concentrations
Concentration HF
Dans un mélange
Insertion à la 19ème ATP,
modification à la 26èmeCatégorie
Phrases de risque
≥ 7 %
Très toxique
CorrosifR26/27/28 : Très toxique par inhalation, contact avec la peau et par ingestion,
R35: Provoque de graves brûlures1 à 7 %
Toxique
R23/24/25 : Toxique par inhalation, contact avec la peau et par ingestion,
R34 : Provoque des brûlures0.1 à 1 %
Nocif
R20/21/22 : Nocif par inhalation, contact avec la peau et par ingestion,
R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peauEtiquetage européen actuellement en vigueur.
Un mélange contenant 2 % d'HF est toujours étiqueté toxique et corrosif, même si le risque létal est moins important que pour une concentration ≥ 7 %.
Dans le nouvel étiquetage européen CLP c , les limites de concentrations sont moins claires concernant le risque de toxicité aiguë mais l'acide fluorhydrique est tout de même classé en toxicité aiguë de catégorie 1 (la plus forte), en cas de contact cutané (phrase de risque H310 – risque mortel en cas de contact cutané).
Comme l'action est plus lente (lorsqu'il s'agit de concentrations diluées) les symptômes associés s'en trouvent retardés :
Concentration
Douleur
50% et plus
Immédiate accompagnée d'une destruction tissulaire rapidement visible
De 20 à 50%
Différée de 1 à 8 heures après le contact (avec érythème dans les mêmes délais)
Moins de 20%
Différée de 24 heures ou plus (avec érythème dans les mêmes délais)
Qu'est ce qu'un fluorure en milieu acide ?
Ce n'est ni plus ni moins que la présence, dans une même solution de ions H+ et F-.
Par exemple, si je mélange un diacide fort, comme l'acide sulfurique H2SO4 avec du fluorure de sodium, NaF :
- H2SO4 se dissocie totalement dans l'eau et libère 2 H+
- NaF est un sel qui s'hydrolyse également complètement dans l'eau, si la solution n'est pas saturée :
NaF <-> Na+ + F-
Dans un bain contenant par exemple 20 % d'acide sulfurique, 40 % de fluorure de sodium et 40 % d'eau il y aura 40 % d'ions H+ et 40 % d'ions F- libres.
C'est d'ailleurs ce type de propriété qui est utilisée en chimie pour augmenter la force d'un décapage chimique.
L'acide fluorhydrique est utilisé pour le décapage de pièces inoxydables.
On peut également utiliser des mélanges dits fluonitriques, qui correspondent à un mélange d'acide nitrique (HNO3) et d'acide fluorhydrique (HF).Exemple de tels mélanges utilisés comme solutions décapantes :
- HF 6 % / HNO3 15 % - Mélange à pH = 1
- Un mélange HF/HNO3/H2SO4 à pH = 1
Le milieu sera alors très acide : Il y aura à la fois des ions H+ provenant de HNO3 (et H2SO4, le cas échéant) et HF, et des fluorures sous la forme F- ou HF
Retenir : Le mélange d'HF avec un acide fort va entraîner une brûlure acide rapide et ainsi créé une « porte d'entrée » aux fluorures, même s'ils sont, en théorie, moins « nombreux » que les H+.
Comment laver les fluorures en milieu acide ?
Réponse : comme une projection d'acide fluorhydrique.
Le meilleur moyen de faire un lavage actif et efficace de ce type de projection est de :- Agir le plus précocement possible, pour éviter que les premières lésions ne se créent ;
- Etre actif à la fois sur les ions H+
- Chélater les ions fluorures F-
Les dispositifs de lavage à l'Hexafluorine® répondent à ces exigences en étant directement accessibles au poste de travail et transportables.
L'hexafluorine® va agir sur l'acide et chélater le fluorure. Son hypertonicité permet de faire ressortir le produit chimique agresseur des tissus de l'œil ou de la peau (phénomène d'osmose) et ainsi de limiter la pénétration et l'action de HF sur les tissus.Retenir : L'utilisation d'une solution active comme l'Hexafluorine®, immédiatement après la projection, permet d'éviter ou de diminuer la pénétration et l'action de l'HF sur les tissus, limitant ainsi le développement de la brûlure et les complications associées. Lors d'un lavage tardif ou insuffisant, un soin secondaire spécifique type gluconate de calcium peut être appliqué, selon le protocole du médecin responsable.
Exemples de fluorures en milieu acide :
Les mélanges fluonitriques :
- HF 6 % / HNO3 15 % - Mélange à pH = 1
- HF 3 % / HNO3 15 %
- Un mélange HF/HNO3/H2SO4 à pH = 1
- Un mélange /HNO3/H2SO4/NaF ou HNO3/NaF
Autres acides susceptibles de libérer des ions F- :
- BF3 (trifluorure de bore)
- H2SiF6 (acide fluorosilicique)
- SiF4 (tetrafluorure de silicium)
- a: McCulley JP., Whiting DW., Petitt MG., Lauber SE,
Hydrofluoric acid burns of the eye., J Occup Med. 1983, 25, 447-50. - b: Dibbell DG., Iverson RE., Jones W., Laub DR., Madison MS.,
Hydrofluoric acid burns of the hand., J Bone Joint Surg Am. 1970 Jul;52(5):931-6. - Classification Labelling Packaging – règlement européen 1272/2008
D'où vient le danger spécifique de l'acide fluorhydrique (HF) ?
L'acide fluorhydrique génère une double action :
- corrosive par les ions acides (H+), capables d'attaquer les tissus en surface, (épithélium cornéen ou épiderme),
- toxique par les ions (F-), qui grâce à la destruction de la couche superficielle de la peau ou de l'oeil par l'acide, vont pouvoir pénétrer en profondeur, chélater le calcium, perturbant ainsi les équilibres biologiques conduisant à des désordres physiologiques plus ou moins profonds.
Les fluorures en milieu acide (comme le trifluorure de bore par exemple) représentent, par définition, le même type de danger.
Intérêt d'un lavage actif à l'Hexafluorine®
A cause de ce danger spécifique, un lavage efficace doit, en plus du simple entraînement mécanique, permettre très rapidement et simultanément de :
- stopper la progression de l'agresseur ayant pénétré dans les tissus
- faire ressortir le produit par le jeu des pressions osmotiques
- absorber tout le potentiel agressif du produit chimique ( H+ et F- )
Ces trois propriétés constituent la notion de lavage actif. C'est en réunissant ces trois critères que la décontamination sera optimale.
J'ai reçu une projection oculaire et ou cutanée d'acide fluorhydrique (HF) :
que dois-je faire ?Une prise en charge efficace est indispensable du fait du double danger de l'HF quelque soit sa concentration :
- les ions acides (H+) créent une brûlure superficielle qui constitue la voie d'entrée
- les ions fluorures (F-) à l'origine d'effets systémiques toxiques pouvant mettre en jeu le pronostic vital.
Quels sont les protocoles utilisables ?
Si le lavage immédiat des brûlures chimique par l'eau a été historiquement le premier réflexe, il a montré très rapidement ses limites en particulier pour les fortes concentrations avec des cas relatés de décès. Cela se comprend car l'eau ne fait que diluer l'HF passivement et en surface.
L'utilisation en complément d'applications ou d'injections locales de gluconate de calcium a représenté un réel progrès du fait d'une action modérée antiacide et d'un certain potentiel de chélation des ions fluorures. Le pronostic vital a été amélioré ainsi que le degré des séquelles mais là encore la littérature internationale rapporte des cas avec nécessité de prise en charge chirurgicale et encore des issues fatales. Indépendamment de difficulté de la standardisation des circonstances d'accident et des cas cliniques, la sécurité et la reproductibilité des résultats amène à une réflexion pratique et concrète de l'amélioration de cette référence existante.
La réflexion pratique a abouti à une optimisation de la prise en charge d'urgence sur le lieu de travail et secondaire en milieu hospitalier dont voici quelques exemples :
- information et formation des personnels,
- mesures de préventions techniques collective et individuelle,
- mise à disposition de stations de lavage à proximité des endroits à risque,
- utilisation de solvants type DMSO pour faciliter l'apport de calcium au niveau des ongles,
- application de gel de gluconate de calcium préventivement avant l'apparition des douleurs,
- ce qui eu également pour conséquences l'amélioration du confort du blessé, excisions précoce des surfaces nécrosées…
La réflexion concrète se place au niveau de l'efficacité du lavage d'urgence et donc naturellement vis-à-vis des deux composantes de la gravité des brûlures par HF qui sont comme nous l'avons vu liées à sa corrosivité et à sa toxicité.
Télécharger « mod_article3810731_2.pdf »
Sources : www.prevor.com
-
Commentaires

 Twitter
Twitter del.icio.us
del.icio.us Facebook
Facebook Digg
Digg Technorati
Technorati Yahoo!
Yahoo! Stumbleupon
Stumbleupon Google
Google Blogmarks
Blogmarks Ask
Ask Slashdot
Slashdot